OECD Economic Surveys: Spain 2023
- https://nadaesgratis.es/cabrales/recomendaciones-de-lectura-la-juventud-atracada
Previsiones
🔹 Banco de España: 1,3 (dic22) -> 1,6 (mar23) -> 2,3 (jun23) -> 2,3 (set23)
🔹 OCDE: 1,3 (nov22) -> 1,7 (mar23) -> 2,1 (jun23) -> 2,5 (oct23)
🔹 Comisión Europea: 1,0 (nov22) -> 1,4 (feb23) -> 1,9 (may23) -> 2,2 (set23)
🔹 FMI: 1,1 (ene23) -> 1,5 (abr23) -> 2,5 (jul23) -> 2,5 (oct23)
Previsiones PIB 2024
🔹 Banco de España: 1,8 (set23)
🔹 OCDE: 1,5 (oct23)
🔹 Comisión Europea: 1,9 (set23)
🔹 FMI: 1,7 (oct23)
- https://read.oecd-ilibrary.org/economics/oecd-economic-surveys-spain-2023_5b50cc51-en#page28
La Organización para el Desarrollo y la Cooperación Económicos (OCDE) visita a España con un informe de recomendaciones para el país. Entre las medidas clave destaca el fin de las medidas de apoyo contra la inflación, considerando que pese al elevado desembolso desplegado por el Gobierno apenas han llegado a los colectivos más vulnerables. La economista jefe de la institución, Clare Lombardelli, propone en Madrid un ajuste fiscal a medio plazo que genere hasta 7.000 millones de euros en ingresos y acelere la reducción del déficit.
El fin de las ayudas antiinflación es un escenario que ya asume el Gobierno para reducir el déficit al 3% del PIB -más optimista que el organismo internacional, que deja este indicador en el 3,5% del PIB- de cara al próximo ejercicio. Este paquete, que incluye medidas como la rebaja fiscal aplicada a la factura de la luz, el gas y la reducción del IVA a algunos alimentos, expira el 31 de diciembre. Al ser un Gobierno en funciones y ante la más que probable situación de Presupuestos prorrogados, el escudo social sería historia el próximo enero. El consecuente alivio fiscal para las cuentas públicas sería de 3.795 millones extra en recaudación, según previsiones oficiales.
Así, la institución prevé que España seguirá incumpliendo los objetivos de déficit con un balance negativo de 3,5 puntos del PIB aun en el cierre de 2024. En vistas a un potente incremento del gasto en pensiones y en envejecimiento, el organismo que lidera Mathias Cormann avisa a España de la necesidad de generar 'espacio fiscal', según el informe Estudio económico de España 2023.
Para ello, recomienda subidas en el Impuesto sobre el Valor Añadido (IVA) hasta alinearlo con la media europea o aumentar los tributos medioambientales. A cambio, la institución plantea recortes de impuestos sobre el trabajo para las rentas bajas con hijos o menor presión fiscal por tributos sobre el capital.
Subida de la presión fiscal de medio punto
La OCDE recoge un paquete de medidas concretas que resultarían en un incremento de la presión fiscal del 0,5% del PIB, unos 6.800 millones extra gracias especialmente a nuevos ingresos.
Propone por el lado de los ingresos eliminar algunos tipos reducidos del IVA y aumentar impuestos verdes sobre el carbón, dos medidas que generarían 10.000 millones. Habría que sumar un alza de tasas al alcohol y tabaco por valor de otros 1.300 millones.
España es uno de los países cuyos ingresos fiscales se asientan en mayor medida sobre la renta y los salarios. Por eso, plantean un alivio de 4.5000 millones para el contribuyente a través de recortes en impuestos sobre la propiedad y sobre el trabajo en rentas bajas. En total, 6.800 millones adicionales para las arcas estatales, medio punto del PIB que dejaría el déficit dentro del objetivo.
La reforma de las pensiones aprobada entre 2021 y 2023 no es una buena noticia en términos fiscales, ya que supone un aumento del déficit de 1,1 puntos del PIB en 2050, además de un importante incremento de la deuda, según la Auditora Independiente de Responsabilidad Fiscal (AIReF).
Con la vista puesta en la mitad de siglo, esta partida aumentará por la elevada tasa de dependencia de la población española, cada vez más envejecida. Por ello, la economista jefe de la OCDE explica que el mayor gasto debe ser tenido en cuenta por las economías desarrolladas y valora medidas adicionales: recortar la generosidad del sistema y recuperar las medidas automáticas para ligar la edad de jubilación a la esperanza de vida para aumentar la edad real de retiro un año y medio, reportando 1.500 millones a la Seguridad Social. La edad efectiva actual está en 65 años, y la edad legal será de 67 años en 2027.
En definitiva, una parte del margen fiscal adicional estaría destinado a mejorar los alquileres sociales, bonificar a las familias de renta baja que tienen hijos y potenciar las subvenciones en educación y cuidados durante la infancia.
El PIB español crecerá un 1,5% en 2024
La economía española terminará creciendo un 2,5% este año, una consistente mejora respecto a las expectativas de hace un año, incluyendo una revisión al alza de la propia institución. "La economía española ha aguantado bien", explica el informe. Respecto a 2024, las previsiones apuntan a un avance del PIB de 1,5%, menos de lo previsto.
El escenario económico actual cuenta con una inflación por encima del objetivo, por eso la política monetaria es más restrictiva y penaliza el consumo o la inversión. De hecho, la inflación se mantendrá en tasas cercanas al 4% aun el próximo curso. Aunque el PIB se moderará, la demanda privada sostendrá gran parte del crecimiento tras un comportamiento positivo de las exportaciones en 2023.
La reducción del desempleo también modera su ritmo. Si en 2022 y 2023 la reducción de esta tasa fue de prácticamente un punto, la proyección es que el mercado laboral continuará su comportamiento positivo ya a un menor ritmo. Así, la tasa de paro se verá reducida hasta el 11,5% en 2024, siendo aun la más elevada de los países desarrollados.
Para la deuda pública también prevé tasas más altas que el Ejecutivo, del 109,4 % del PIB en 2023 y del 110 % en 2024.
Productividad
La baja productividad española, el gran reto de la reducción de la jornada laboral
Con excepciones, el PIB per capita de Noruega es muy superior a la de Suecia por las rentas del petroleo.
La inversión en equipamiento de las empresas y la productividad es crucial para asegurar la sostenibilidad del crecimiento de la economía española
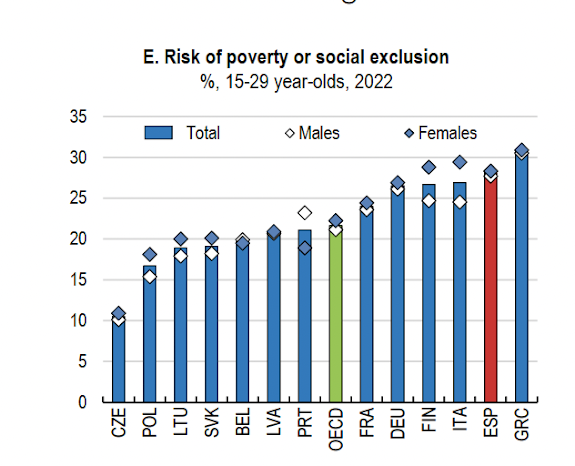
España es el país de la UE con más parados y más desempleo juvenil
- https://www.eleconomista.es/economia/noticias/12506715/10/23/la-ocde-recomienda-a-espana-eliminar-las-ayudas-antiinflacion-y-recaudar-7000-millones-mas.html
- https://www.diariosur.es/economia/pensiones/fedea-poco-plausibles-proyecciones-seguridad-social-sobre-20231023113129-ntrc.html
- https://www.funcas.es/articulos/el-futuro-del-sistema-de-pensiones-demografia-mercado-de-trabajo-y-reformas/
- https://www.funcas.es/videos/la-apremiante-culminacion-de-la-reforma-de-las-pensiones/
- https://documentos.fedea.net/pubs/eee/2023/eee2023-31.pdf?utm_source=wordpress&utm_medium=actualidad&utm_campaign=estudio&_ga=2.101388929.1615224146.1698216790-1727224629.1673451187&_gl=1*13krkpf*_ga*MTcyNzIyNDYyOS4xNjczNDUxMTg3*_ga_K71EGLC8JC*MTY5ODIzMzg2NS4yMS4xLjE2OTgyMzM4NjcuMC4wLjA
- Meritocracia y desigualdad de oportunidades educativas | Negocios | EL PAÍS (elpais.com)
- https://www.funcas.es/videos/pensiones-y-gasto-publico-ante-la-inflacion/
- Productividad
- https://forosenar.blogspot.com/2023/10/productividad.html
- Pymes sin crecer España sin avanzar | Articulos.claves (articulosclaves.blogspot.com)
- La productividad no crece en España desde los 90 | Articulos.claves (articulosclaves.blogspot.com)
- https://articulosclaves.blogspot.com/2023/10/la-productividad-no-crece-en-espana_22.html
- ¿Quien estudia las causas de abandono en el primer año de universidad?Los profesores están muy preparados, pero el sistema de partir el curso en dos semestres en muchas universidades no funciona, porque en realidad el temario es de un año. No se asimila. Los alumnos no tienen tiempo para estudiar todo el temario y los problemas. Es imposible.Si no se aprueba, no se puede tener la oportunidad de septiembre de dos meses, hay que volver a empezar un año después.-Mejor seria menos temario y mejor aprendido-Mejor seria volver a las clases de 1h en vez de 45 minutos-Mejor seria enseñar con menos p.point, porque la velocidad con la cual se explica, es imposible de asimilar
- En busca de un relevo al consumo La geopolítica y la inversión condicionan el mantenimiento del diferencial de crecimiento